2021年5月17日,上海瓔黎藥業(yè)有限公司(以下簡(jiǎn)稱“瓔黎藥業(yè)”)宣布,公司自主研發(fā)的創(chuàng)新藥PI3Kδ選擇性抑制劑林普利司片(代號(hào):YY-20394)新藥上市申請(qǐng)(NDA)已獲得國(guó)家藥品監(jiān)督管理局(NMPA)藥品審評(píng)中心(CDE)正式受理,受理編號(hào):CXHS2101013,擬用于治療復(fù)發(fā)/難治濾泡性淋巴瘤。

圖片來源:CDE
據(jù)恒瑞醫(yī)藥公告,林普利司是瓔黎藥業(yè)研發(fā)的1類創(chuàng)新藥。

圖片來源:藥物臨床試驗(yàn)登記與信息公示平臺(tái)
2018年10月,林普利司獲得了美國(guó)FDA兩項(xiàng)孤兒藥資格的授予(CLL/SLL, FL)。林普利司此前已在中國(guó)和美國(guó)開展了?項(xiàng)臨床試驗(yàn)。2020年5月,獲準(zhǔn)在美國(guó)開展II期臨床研究;2021年3月30日,瓔黎藥業(yè)宣布,林林普利司在中國(guó)開展的一項(xiàng)針對(duì)復(fù)發(fā)/難治濾泡型淋巴瘤患者的II期注冊(cè)臨床試驗(yàn)(YY-20394-002 )取得積極結(jié)果。
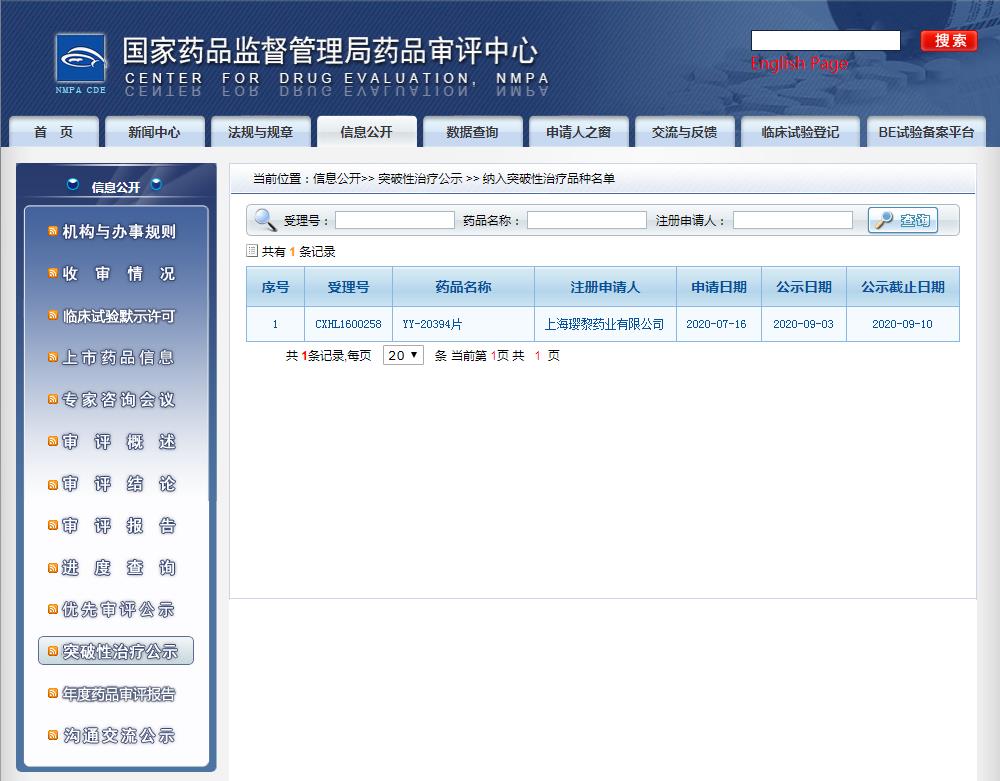

圖片來源:CDE
2020年9月,獲得中國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)突破性療法認(rèn)定,用復(fù)發(fā)和/或難治濾泡性淋巴瘤。
在國(guó)內(nèi),還沒有同靶點(diǎn)的上市藥物。目前已經(jīng)有兩款藥物獲得了CDE優(yōu)先審評(píng)資格,分別為Copanlisib和度恩西布,拜耳靜脈注射用PI3K抑制劑Copanlisib于3月10日在國(guó)內(nèi)申報(bào)上市,石藥集團(tuán)引進(jìn)的PI3K-δ和PI3K-γ口服雙重抑制劑度恩西布于4月21日在國(guó)內(nèi)申報(bào)上市。
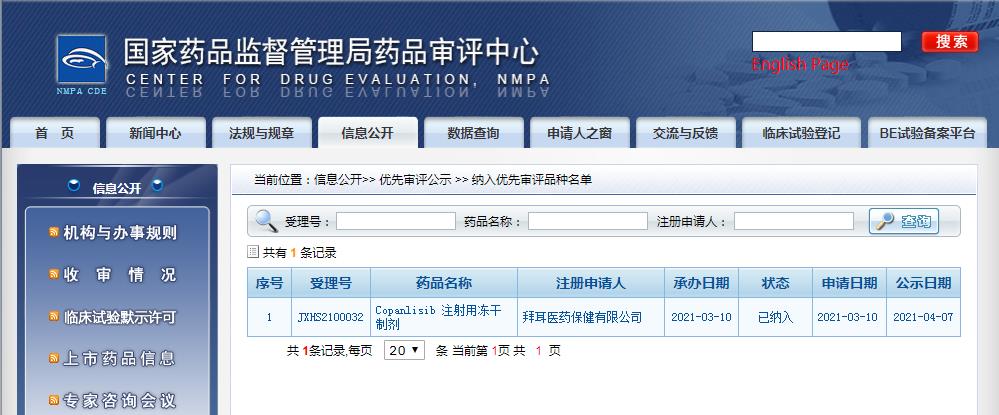

圖片來源:CDE
作為一款即將獲批上市的PI3Kδ高選擇性抑制劑,林普利司片將有望為國(guó)內(nèi)濾泡性淋巴瘤患者帶來新的治療選擇。
